研制出用于脑胶质瘤治疗的颅内植入式可降解蚕丝蛋白微针贴片
文章来源:一室 | 发布时间:2021-10-24
文章来源:一室 | 发布时间:2021-10-24 | 【打印】 【关闭】
脑胶质瘤是中枢神经系统最常见的恶性肿瘤,约占颅内肿瘤的46%,平均生存时间仅为12-15个月,在35-55岁人群主要死亡原因排名第三位,对人民生命健康危害极大。目前,最大化切除肿瘤,联合术后的放化疗是临床治疗脑胶质瘤的标准方案。然而,由于脑胶质瘤浸润性生长的特点,肿瘤区域与周围正常组织边界模糊不清,致使无法完全切除肿瘤而易复发。并且,采用常规静脉注射化疗药物时,由于血脑屏障的阻碍等原因,实际疗效欠佳。
面向人民生命健康,围绕以脑胶质瘤为代表的重大脑疾病临床治疗中对新型植入式医疗器械的迫切需求,中科院上海微系统所陶虎研究员团队与复旦大学附属华山医院神经外科毛颖教授团队合作,创新开发出基于蚕丝蛋白的异质、异构、可降解微针贴片(图1)。该贴片采用颅内局部缓释的多药物协同递送模型,可以在时间和空间上保证肿瘤区域较为稳定的药物浓度,减轻全身毒副作用。在切除颅内肿瘤的手术过程中,即可将该微针贴片原位埋覆在瘤腔之内从而绕过血脑屏障,待其完成药物缓释治疗后可完全降解消失,无需二次手术取出。蚕丝蛋白优异的生物相容性不会引起组织免疫反应,在其保护作用下还可以有效延长所携带药物的活性。而微针结构还提供了药物到达组织深处的通道,能够提升对残留肿瘤细胞的杀伤效果。在该贴片的柔性基底、中心和周围微针区域分别集成了止血、抗肿瘤和抑制血管生成药物,通过改变蚕丝蛋白微观晶体结构的组成,可定义微针贴片不同部位的降解时间,从而达到不同药物快速释放止血(几分钟)和长期缓释抑制肿瘤(几周)的目的。在此基础上,通过建立基于近红外光-金纳米壳-木瓜蛋白酶的光热转化触发酶降解给药机制,进一步解决了体外按需定时启动(手术恢复期过后几天)体内抗血管生成药物释放的难题,满足了临床应用中对不同药物释放顺序和周期的特殊需求(图2)。在动物实验中,采用蚕丝蛋白载药微针贴片的治疗组有效抑制了肿瘤体积,显著延长了小鼠生存期。其中,与空白组和注射组相比,微针贴片治疗组小鼠的中位生存期分别提升了83%和41%。预示着蚕丝蛋白微针贴片在跨血脑屏障药物递送、多药物局域协同作用、颅内肿瘤微环境调控等重大脑疾病诊治的关键应用中将发挥重要作用。
相关研究成果以“Silk Microneedle Patch Capable of On-Demand Multidrug Delivery to the Brain for Glioblastoma Treatment”为题于2021年10月7日发表在学术期刊Advanced Materials(Adv. Mater. 2021, 2106606)上。
该论文的第一通讯单位为中科院上海微系统所,通讯作者为上海微系统所陶虎研究员。该工作得到国家重点研发计划、国家自然科学基金优秀青年基金、中国科学院基础前沿科学研究计划“从0到1”原始创新项目、上海市优秀学术带头人计划等相关研究计划的支持。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202106606 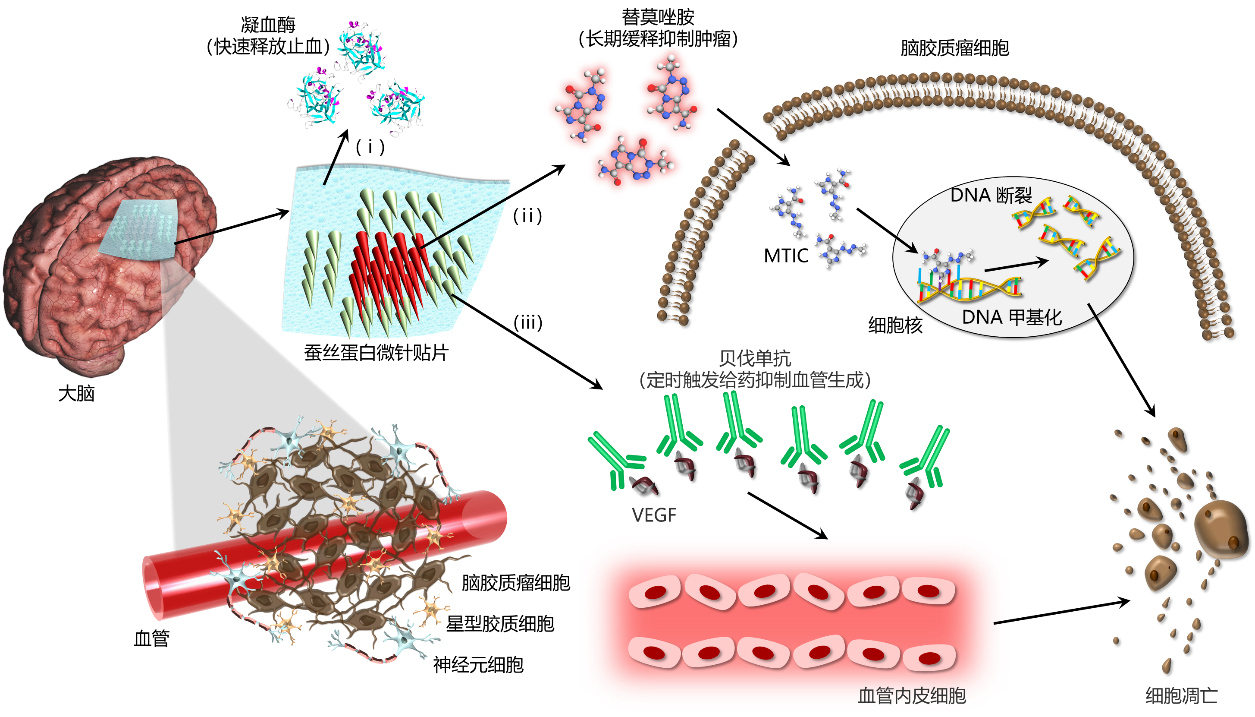
图1. 蚕丝蛋白微针贴片用于脑胶质瘤治疗的颅内多药物递送机制
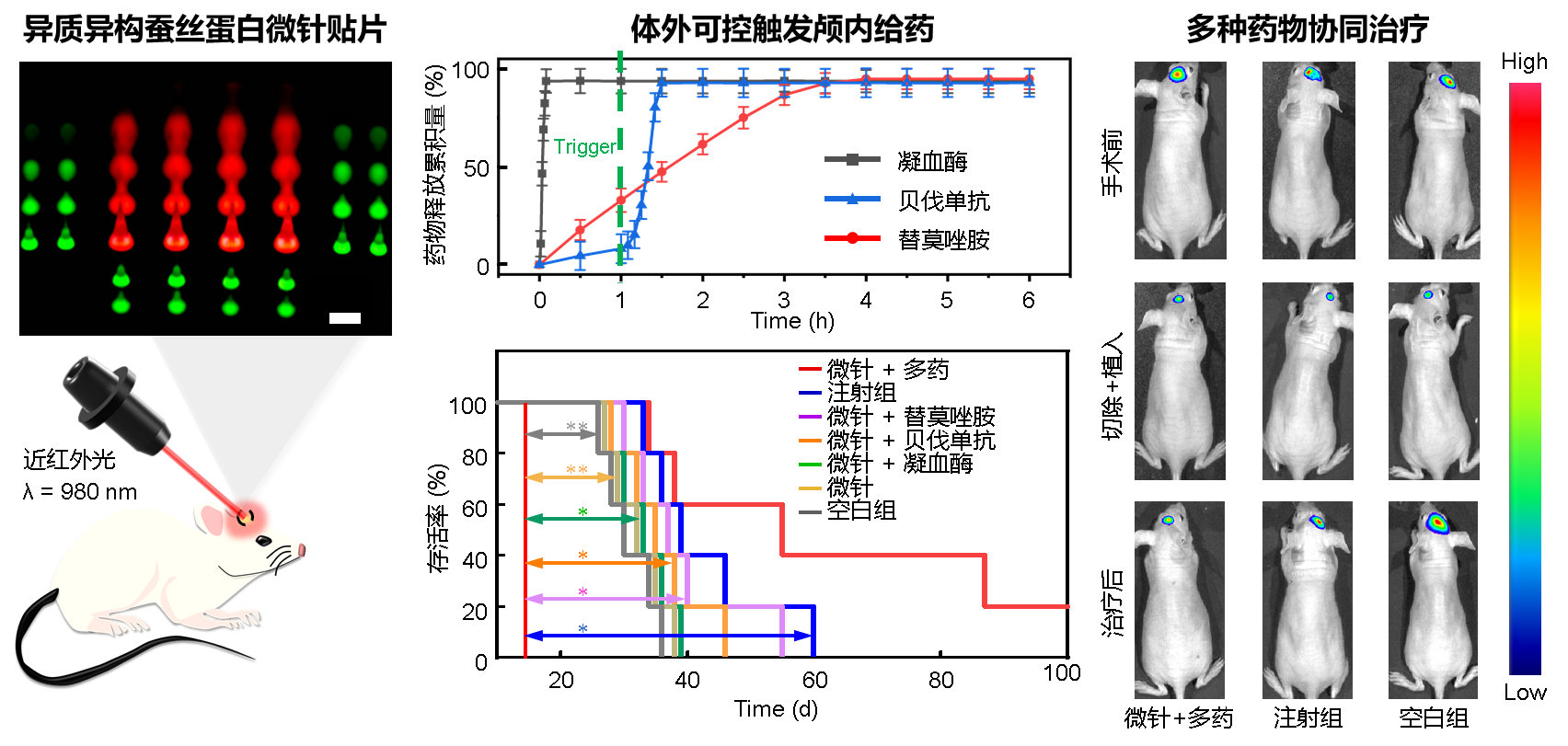
图2. 异质异构蚕丝蛋白微针贴片可控缓释药物有效抑制脑胶质瘤

