上海微系统所在微流控光化学、水凝胶离子器件等技术方面取得进展
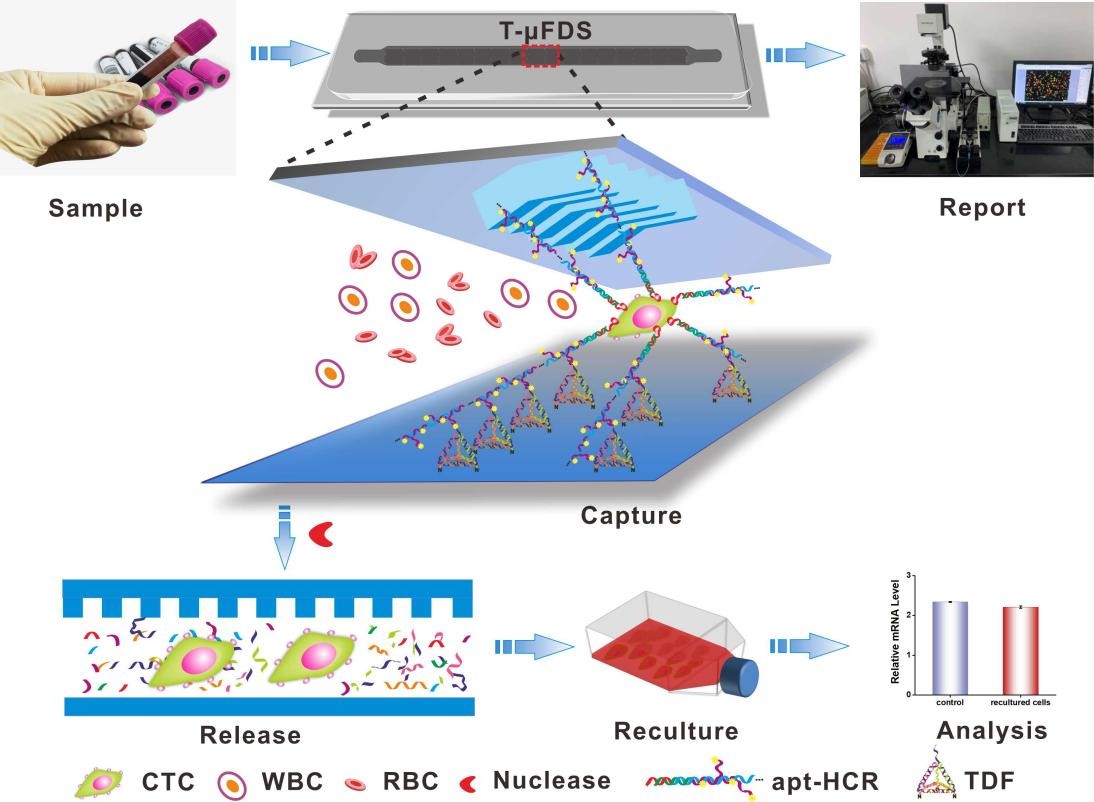
循环肿瘤细胞(CTCs)存在于癌症患者外周血中,对癌症的早期诊断和预后评估具有十分重要的临床应用价值。然而,CTCs在外周血中数量极少且具有异质性,从血液中检测及分离CTCs相当困难。传统的CTCs分选技术包括密度梯度离心分选、免疫磁珠分选、介电泳分选等,这些方法操作步骤复杂,捕获效率和纯度低,捕获后的细胞难以释放且易损伤,不利于后续分析。目前CTCs 分析的金标准是美国食品和药物管理局(FDA)批准的Cell Search系统,可检测转移性乳腺癌、前列腺癌和直肠癌患者血液中的CTCs。但该系统的分离纯度极低,只有0.5%,且通过该系统只能对CTCs计数,不能捕获和释放后再分析,在我国已经停用。因此,迫切需要发展新材料、新技术以实现CTCs的检测和分离,且具有高捕获效率、高特异性及高通量。
近日,中国科学院微系统与信息技术研究所超导电子学实验室宓现强课题组将aptamer触发的HCR反应(apt-HCR)、鱼骨型微流控芯片(HB-chip)与氨基修饰的四面体框架核酸(Tetrahedral DNA framework, TDFs)相结合,构建了一种CTCs分选微流控系统(T-μFDS)。TDFs不仅可以作为三维支架以醛基-氨基共价结合的方式固定于玻璃基底上,其顶端探针还可与apt-HCR中的多分支链杂交,最终实现CTCs多价捕获。由于TDF、HCR和aptamer均是DNA分子,可以利用核酸酶消化,实现CTCs无损伤释放。当靶细胞(MCF-7)数量为10-105时,该系统捕获效率为80.0 %-97.4 %,捕获纯度为92.0 %-96.7 %,对MCF-7细胞的释放效率为96.2 %,MCF-7 细胞在被捕获前和释放后的存活率分别为 97.5 % 和 94.6 %。综上,本系统具有捕获效率高、捕获纯度高、释放效率高和细胞活力维持能力强的巨大优势。结合微流控芯片技术,该系统有望实现整体自动检测和分离CTCs。
相关论文“Designer Tetrahedral DNA Framework-Based Microfluidic Technology for Multivalent Capture and Release of Circulating Tumor Cells”发表于国际知名期刊Materials Today Bio(授权发明专利201910646213.4)。该论文的第一通讯单位为中科院上海微系统所,通讯作者为上海微系统所宓现强研究员。
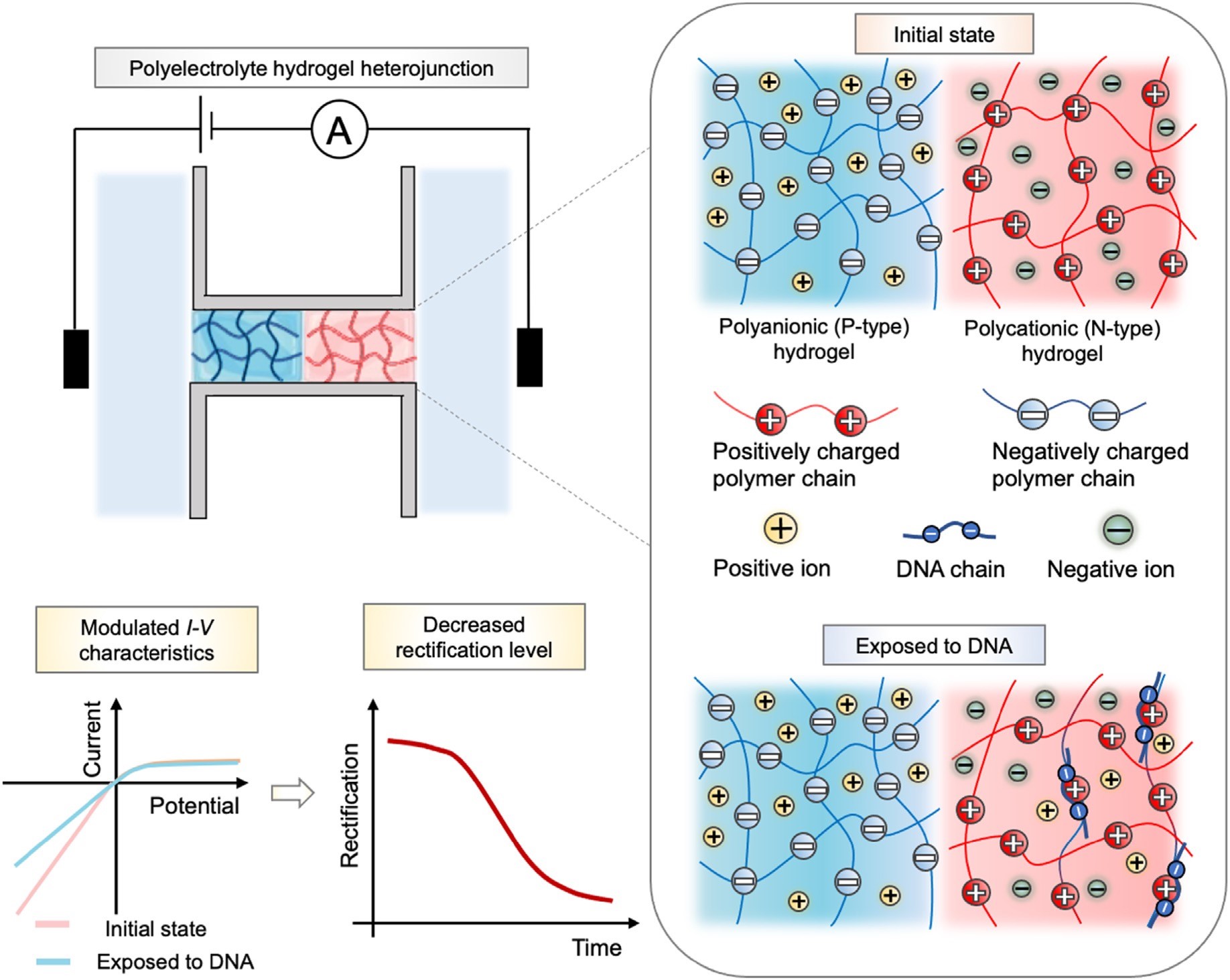
近期,宓现强研究员团队和上海科技大学刘一凡研究员课题组合作,发展了集成化的水凝胶离子二极管,实现了对DNA分子的无标记定量检测和核酸扩增过程的实时监测,相关论文“Label-free electrical monitoring of nucleic acid amplification with integrated hydrogel ionic diodes”同样发表于国际知名期刊Materials Today Bio。其中中科院上海微系统所为共同通讯单位,宓现强研究员为共同通讯作者。
相关工作得到中国科学院STS项目(KFJ-STS-QYZD-2021-08-002)、上海市优秀学术带头人计划(20XD1404600),上海市科委项目(19511107102, 20511107600)等的资金支持。
微流控光化学论文链接:
https://doi.org/10.1016/j.mtbio.2022.100346
水凝胶离子二极管论文链接 https://doi.org/10.1016/j.mtbio.2022.100281